Accès dérogatoire aux médicaments
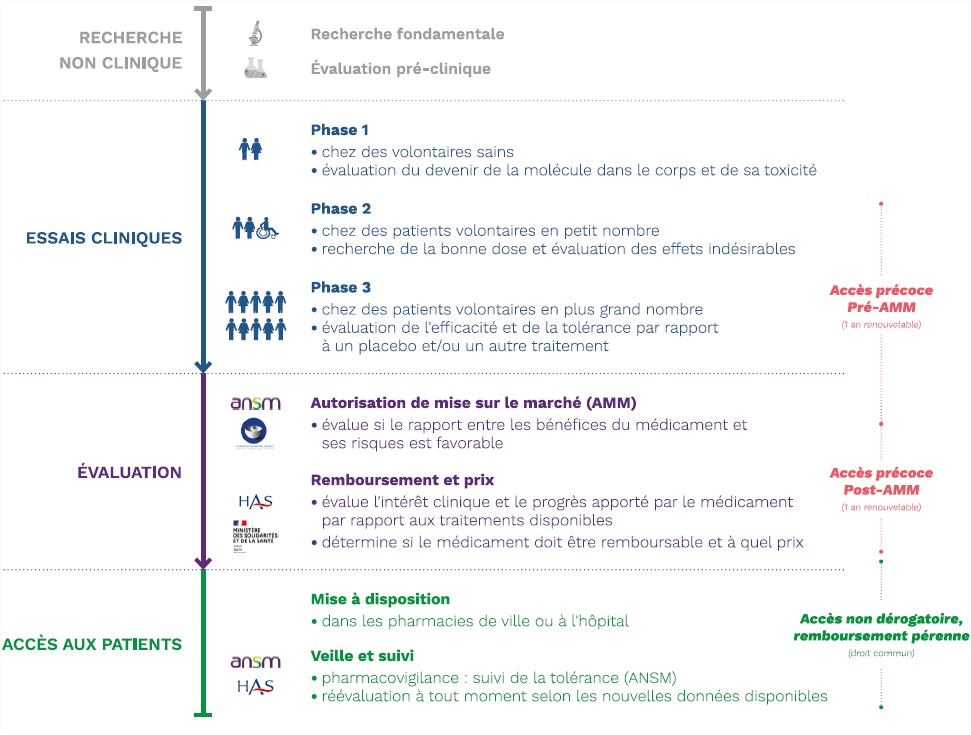
En France, les patients en situation d’impasse thérapeutique peuvent bénéficier, à titre exceptionnel et temporaire, de certains médicaments innovants n’ayant pas encore leur Autorisation de Mise sur le Marché (AMM) dans l’indication concernée.
Pour bénéficier d’un accès dérogatoire, 4 conditions doivent être réunies :
- le médicament doit être destiné à traiter des maladies graves, rares ou invalidantes ;
- il n’existe pas de traitement approprié disponible sur le marché ;
- la mise en oeuvre du traitement ne peut pas être différée ;
- l’efficacité et la sécurité du médicament sont fortement présumées.
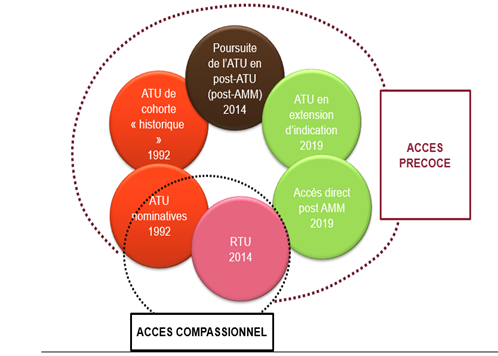
Depuis le 1er juillet 2021, deux nouveaux dispositifs viennent remplacer les 6 existants :
| Autorisation d’Accès Précoce (AAP) | Autorisation d’Accès Compassionnel (AAC) |
| Pour les médicaments, présumés innovants, destinés à être commercialisés dans l’indication concernée (données cliniques disponibles ou en cours de recueil)
Remplace les ATU de cohorte, les ATU d’extension indication, les post-ATU et les prises en charge temporaires |
Pour les médicaments non destinés à être commercialisés dans l’indication concernée (absence de développement en cours/prévu, pas de démarche en vue d’une AMM)
Remplace les ATU nominatives et RTU |
| Sur demande du laboratoire auprès de la Haute Autorité de Santé (HAS) | Sur initiative de l’ANSM, à la demande de professionnels de santé, des ministres ou sur signalements |
Ces AAP peuvent concerner :
|
Deux cas d’AAC :
Dérogation à l’AAC :
|
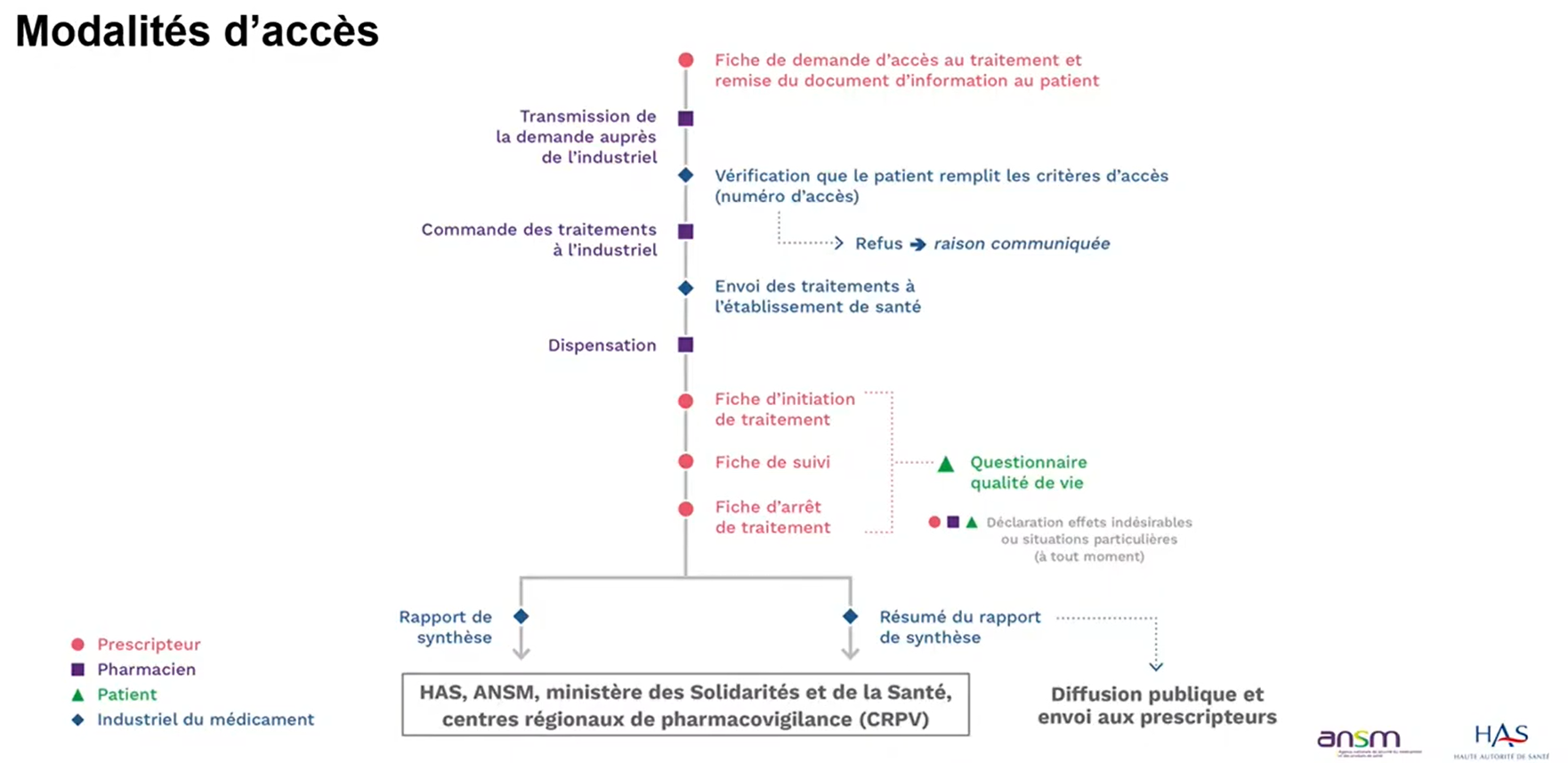
Demande d’autorisation, prescription et délivrance
Les demandes d’AAP sont réalisées par le laboratoire exploitant auprès de la HAS. L’évaluation doit se faire en 3 mois maximum. L’AAP est délivrée pour une durée maximale d’un an renouvelable.
Chaque AAP est accompagnée d’un Protocole d’Utilisation Thérapeutique et de Recueil des Données (PUT-RD) qui contient :
- la description du médicament, les conditions d’utilisation et de prescription ;
- des documents d’information à remettre au patient avant l’initiation du traitement ;
- des fiches de suivi de traitement (recueil des effets indésirables, des situations particulières et les données d’utilisation du médicament).
Le prescripteur s’engage à respecter les conditions d’utilisation décrites dans le PUT, à informer le patient, à recueillir et transmettre au laboratoire les données cliniques, et à déclarer tous les effets indésirables et situations particulières.
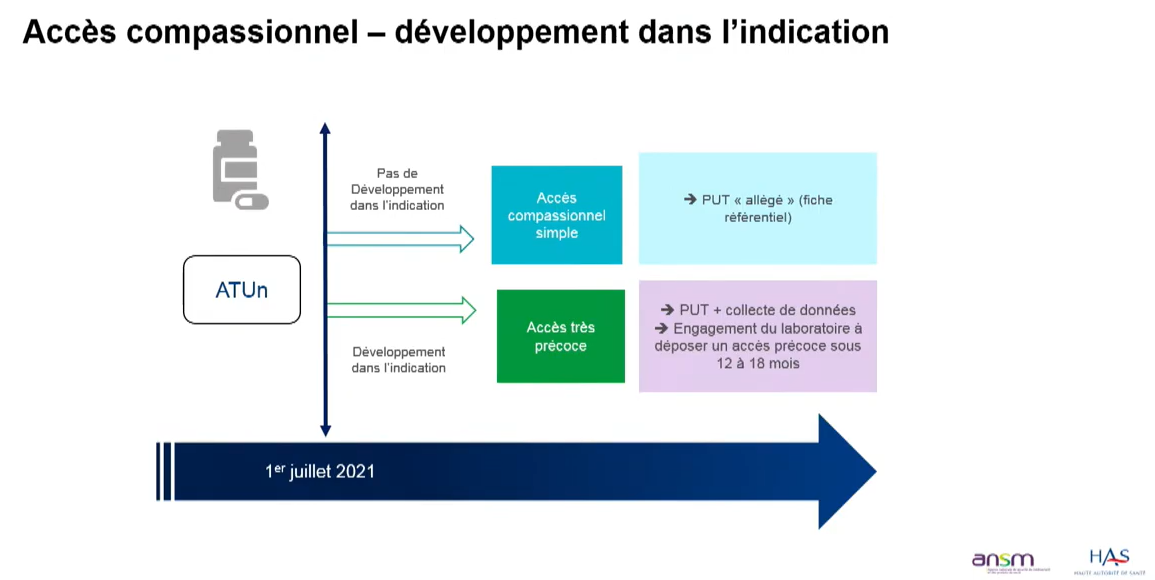
A noter, les ATU de cohorte (ATUc) en cours ne deviennent pas automatiquement des AAP. Pour cette raison, les ATUc et les AAP coexisteront pendant une année.
Les demandes d’AAC s’effectuent auprès de l’ANSM, via la plateforme e-SATURNE (disponible 24 h/24 et 7 jours/7).
En dehors des heures ouvrables, un accord oral de l’astreinte ANSM n’est plus obligatoire si la demande d’AAC est jugée conforme aux critères d’octroi par le prescripteur et le pharmacien de la pharmacie à usage intérieur. Une régularisation est à effectuer a posteriori via la plateforme e-SATURNE. Le système d’astreinte est cependant maintenu, notamment en cas d’urgence vitale.
Le référentiel des autorisations d’accès compassionnel recense la grande majorité des médicaments disponibles en AAC, ainsi que les critères d’octroi et autres informations utiles (résumé des caractéristiques du produit et éventuellement le protocole d’utilisation thérapeutique). La prescription doit s’appuyer sur le référentiel.
Financement des médicaments bénéficiant d’un accès dérogatoire
| Accès Compassionnel (AAC) | Accès précoce (AAP) |
| Etablissement de santé :
Le financement des médicaments bénéficiant d’un accès dérogatoire se fait en sus des GHS. Le montant remboursé est le prix d’achat indiqué par l’établissement, toutes taxes comprises. Les dépenses relatives aux médicaments sous AAC et AAP doivent être remontées par les établissements de santé à l’aide de l’outil FICHCOMP-ATU du PMSI, grâce au codage de ces derniers par Unité Commune de Dispensation (code UCD). >> Les référentiels du Ministère listent les codes UCD des médicaments et les indications dans lesquelles ils bénéficient d’un AAP ou AAC autorisé par la HAS ou l’ANSM. |
|
| Rétrocession :
Les médicaments rétrocédés sont pris en charge à 100% dès l’octroi de l’autorisation. Le prix facturé tient compte de la TVA applicable (2,1%) et de la marge forfaitaire par ligne de prescription. |
|
Codage des indications
De nouvelles modalités de recueil et de transmission des données relatives aux médicaments sous AAP et AAC sont mises en œuvre :
- Pour les médicaments sous AAP : code d’indication spécifique commençant par C suivi des 4 premières lettres de la DCI puis 2 chiffres, attribué à chaque indication conformément au référentiel du ministère.
- Pour les médicaments sous AAC : code d’indication spécifique commençant par N suivi des 4 premières lettres de la DCI puis 2 chiffres, attribué à chaque indication conformément au référentiel du ministère.
Ces codes indications sont disponibles dans 2 tableaux régulièrement mis à jour sur le site internet du Ministère des Solidarités et de la Santé : cliquez ici
L’ATIH met également à disposition une table regroupant les codes des médicaments sous accès dérogatoire sur son site.
Le code indication doit être transmis par les établissements de santé MCO (y compris HAD) au moment de la facturation via le formulaire FICHCOMP-ATU (établissements ex-DG) ou RSF-H (établissements ex-OQN).
Liens utiles
- Webinaire « Réforme ATU / RTU : quels changements pour les patients et les professionnels de santé ? » (ANSM et HAS, 2021) : cliquez ici
- Ministère des Solidarités et de la santé :
- Page dédiée aux AAC et AAP : cliquez ici
- Fiche technique des APP et AAC : cliquez ici
- ANSM :
- Page dédiée aux AAC et AAP : cliquez ici
- La liste des médicaments faisant l’objet d’une AAP ou d’une AAC
- L’accès à la plateforme e-SATURNE pour les demandes d’AAC : cliquez ici
- HAS :
- Page dédiée sur la prescription d’un médicament en accès précoce : cliquez ici
- Réglementation :
- Article L. 162-16-5-2 du code de la sécurité sociale : cliquez ici
- Décret n°2021-869 relatif aux autorisations d’accès précoce et compassionnel : cliquez ici
- Circulaire du 8 juillet 2014 relative aux conditions de mise en œuvre de l’article 48 de la LFSS 2014 : cliquez ici
Retrouvez également nos autres pages sur les « médicaments à statuts particuliers » :




