Circuit des dispositifs médicaux implantables
Retrouvez différents outils pratiques relatifs à la sécurisation du circuit des dispositifs médicaux implantables (DMI).
Réglementation
Règlement européen (UE) 2017/745
Le règlement européen (UE) 2017/745 relatif aux dispositifs médicaux est entré en vigueur le 26 mai 2021. Il a pour objectif de renforcer la sécurité des dispositifs médicaux et introduit de nouvelles exigences :
- L’IUD ou Identifiant Unique du Dispositif = « série de chiffres ou de lettres créée selon des normes internationalement acceptées d’identification et de codification de dispositifs et qui permet l’identification formelle de dispositifs donnés sur le marché » (art.2 -15).
L’IUD est un système d’identification reposant sur :
- l’attribution d’un IUD à tous les dispositifs (exceptés DM sur mesure et DM d’investigations cliniques)
- l’apposition de l’IUD sur l’étiquette ou sur le DM et sur tous les niveaux de conditionnements supérieurs (sauf conteneurs d’expédition)
- l’enregistrement dans la base de données européenne des DM (EUDAMED)
- l’enregistrement dans les systèmes informatiques des opérateurs (fabricant, distributeur, mandataire, importateur, établissement)
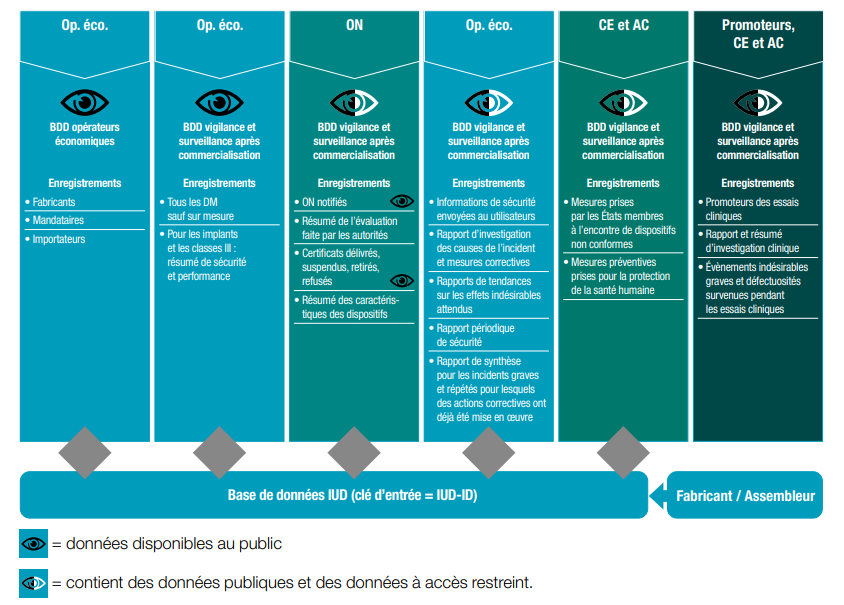
- EUDAMED = base de données européenne sur les DM, dont la finalité est d’assurer la coordination entre les autorités compétentes de chaque pays et le partage d’informations.
La base de données EUDAMED, composée de 6 modules, va permettre
- d’avoir accès à des informations sur les DM (résumé des caractéristiques de sécurité et des performances cliniques (RCSPC), état stérile ou non, classe de risque du dispositif, mises en garde ou contre-indications importantes…)
- de connaître les incidents déclarés et l’avancée des investigations cliniques
- de renforcer la coordination et la coopération entre les différents acteurs
Ci-dessous une modélisation de sa structure avec les différents modules et l’accessibilité ou non du contenu au public.
- La carte d’implant et informations à fournir au patient : les fabricants et les établissements doivent fournir des informations au patient (identification du dispositif, mises en garde à prendre par le patient ou par un professionnel de santé vis à vis des examens médicaux, durée de vie du dispositif…) ainsi qu’une carte d’implant remise avec le DMI (sauf certains DMI)
Le Medical Device Coordination Group met à disposition un guide sur les informations à fournir aux patients avec des exemples de présentation pour la carte d’implant.
Arrêté du 8 septembre 2021
L’arrêté du 8 septembre 2021 relatif au système de management de la qualité du circuit des DMI dans les établissements de santé et les installations de chirurgie esthétique a pour objectifs de :
- Mettre en œuvre un système de management de la qualité du circuit des DMI
- Sécuriser et améliorer l’organisation du circuit du DMI à toutes les étapes du circuit
- Améliorer la traçabilité sanitaire des DMI
Circuit des DMI
Système de management de la qualité du circuit des DMI
Les OMEDIT du Grand-Ouest proposent un modèle de fiche de poste du responsable du système de management de la qualité (RSMQ) du circuit des DMI.
Autoévaluation des risques du circuit des DMI
L’ANAP (Agence Nationale d’Aide à la Performance) met à disposition Inter Diag DMS-DMI, un outil d’autodiagnostic, permettant d’objectiver les points critiques liés à la prise en charge des Dispositifs Médicaux Stériles (DMS) et des Dispositifs Médicaux Implantables (DMI) composé de 2 modules : Pharmacie à Usage Intérieur (PUI) et Unités de Soins et plateaux médico-techniques (US).
Cet outil permet :
- d’évaluer et d’objectiver le niveau de sécurisation du circuit des DMS et des DMI
- d’établir la cartographie des risques liés au circuit des DMS et des DMI
- d’identifier les axes prioritaires d’amélioration
- d’engager les établissements dans des plans d’action opérationnels
Informatisation du circuit des DMI
Le RESOMEDIT propose un outil de cartographie des systèmes d’information du circuit des DMI. Cet outil s’adresse à toute personne impliquée dans la traçabilité des DMI au sein de son établissement : direction, RSMQ-DMI, pharmacien, référent informatique, correspondant local de matériovigilance, professionnel du bloc opératoire… Il a pour objectifs de :
- Susciter le dialogue entre les différents acteurs du circuit des DMI
- Disposer d’un état des lieux des logiciels utilisés et leur interopérabilité
- Evaluer la possibilité d’intégration de l’identifiant unique des dispositifs (IUD) à toutes les étapes du circuit
- Définir les priorités d’amélioration et le plan d’actions associé
Traçabilité sanitaire des DMI
Guide de traçabilité des DMI
Audit sur la traçabilité sanitaire des DMI
Retrouvez toutes nos pages relatives aux dispositifs médicaux